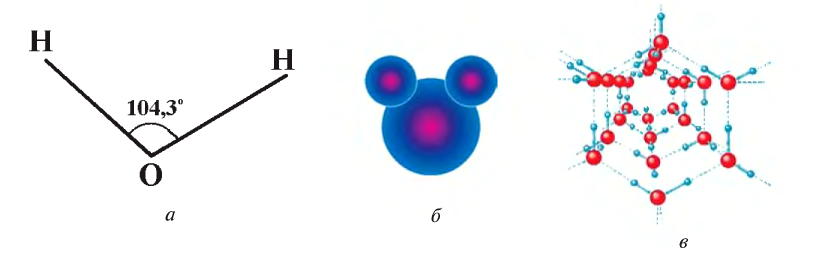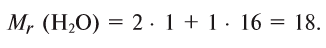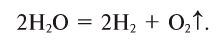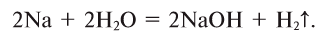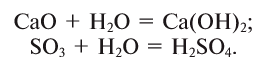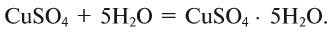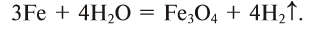Молекулярная масса воды как найти
Молярная масса воды
Молярная масса воды
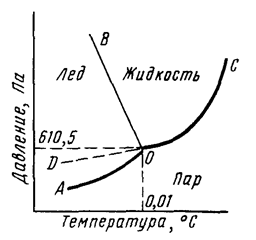
Вода – это наиболее распространенное вещество в природе. Она представляет собой термодинамически устойчивое соединение, способное находиться сразу в трех агрегатных состояниях: жидком, твердом (лед) и газообразном (водяной пар), каждое из которых определяется температурой и давлением (рис. 1).
Рис. 1. Диаграмма состояния воды.
Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Брутто-формула воды – H2O. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что молярная масса воды равна 18 г/моль.
Примеры решения задач
| Задание | Рассчитайте массовую долю элементов в следующих молекулах: а) воды (H2O); б) серной кислоты (H2SO4). |
| Ответ | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Рассчитаем массовые доли каждого из элементов, входящих в состав указанных соединений.
а) Найдем молекулярную массу воды:
Mr (H2O) = 2×1,00794 + 15,9994 = 2,01588 + 15,9994 = 18,0159.
Известно, что M = Mr, значит M(H2O) = 32,2529 г/моль. Тогда массовые доли кислорода и водорода будут равны:
ω (H) = 2 × Ar (H) / M (H2O) × 100%;
ω (H) = 2 × 1,00794 / 18,0159 × 100%;
ω (H) = 2,01588 / 18,0159× 100% = 11,19%.
ω (O) = Ar (O) / M (H2O) × 100%;
ω (O) = 15,9994 / 18,0159× 100% = 88,81%.
б) Найдем молекулярную серной кислоты:
Mr (H2SO4) = 2×1,00794 + 32,066 + 4×15,9994 = 2,01588 + + 32,066 + 63,9976;
Известно, что M = Mr, значит M(H2SO4) = 98,079 г/моль. Тогда массовые доли кислорода, серы и водорода будут равны:
ω (H) = 2 × 1,00794 / 98,079 × 100%;
ω (H) = 2,01588 / 98,079× 100% = 2,06%.
ω (S) = 32,066 / 98,079× 100% = 32,69%.
ω (O) = 4×15,9994 / 98,079× 100% = 63,9976/ 98,079× 100% = 65,25%
| Задание | Вычислите, где каком из соединений массовая доля (в %) элемента водорода больше: в метане (CH4) или сероводороде (H2S)? |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Рассчитаем массовую долю каждого элемента водорода в каждом из предложенных соединений (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева округлим до целых чисел).
Найдем молекулярную массу метана:
Mr (CH4) = 4×1+ 12 = 4 + 12 = 16.
Известно, что M = Mr, значит M(CH4) = 16 г/моль. Тогда массовая доля водорода в метане будет равна:
ω (H) = 4 × Ar (H) / M (CH4) × 100%;
ω (H) = 4 × 1 / 16 × 100%;
ω (H) = 4/ 16 × 100% = 25%.
Найдем молекулярную массу сероводорода:
Mr (H2S) = 2×1+ 32 = 2 + 32 = 34.
Известно, что M = Mr, значит M(H2S) = 34 г/моль. Тогда массовая доля водорода в сероводороде будет равна:
ω (H) = 2 × Ar (H) / M (H2S) × 100%;
ω (H) = 2 × 1 / 34 × 100%;
ω (H) =2/ 34 × 100% = 5,88%.
Таким образом, массовая доля водорода больше в метане, поскольку 25 > 5,88.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Молекулярная масса
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
п.2. Количество вещества. Постоянная Авогадро
Например:
В 5 молях углерода будет содержаться \(N=5\cdot N_A\approx 6,022\cdot 10^<23>\approx 3,01\cdot 10^<24>\) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет \(N=5\cdot N_A\approx 3,01\cdot 10^<24>\) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Например:
Найдем молярную массу этилового спирта \begin
п.4. Молярный объем
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы \(\mathrm
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода \(\mathrm
Молярная масса воды
Молярная масса воды.
Молярная масса воды:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅10 23 моль −1 ).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12 C.
Молярную массу обозначают M.
Молекула воды – H2O.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же. Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
§ 2.2. Масса молекул. Постоянная Авогадро
Масса молекулы воды
В предыдущем параграфе мы выяснили, что в 1 г воды содержится 3,7 • 10 22 молекул. Следовательно, масса одной молекулы равна
Массы такого же порядка имеют и молекулы других веществ, исключая огромные молекулы органических соединений. Например, масса молекулы гемоглобина превышает массу молекулы воды в несколько десятков тысяч раз.
Относительная молекулярная масса
Так как массы молекул очень малы, удобно использовать не абсолютные значения масс, а относительные. По международному соглашению, принятому в 1961 г., массы всех молекул сравнивают с 

Относительной молекулярной (или атомной) массой вещества Мг называют отношение массы молекулы (или атома) данного вещества к 
Относительные атомные массы всех химических элементов точно измерены. Складывая относительные атомные массы, можно вычислить относительную молекулярную массу. Например, относительная молекулярная масса воды Н20 приближенно равна 18, так как относительные атомные массы водорода и кислорода примерно равны 1 и 16 : 2 • 1 + 16 = 18.
Количество вещества
Чем больше атомов или молекул в макроскопическом теле, тем, очевидно, больше вещества содержится в нем. Число молекул в макроскопических телах огромно. Поэтому удобно указывать не абсолютное число атомов, а относительное.
Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г. Относительное число атомов или молекул в теле характеризуется особой физической величиной, называемой количеством вещества.
Количеством вещества v называют отношение числа молекул N в данном теле к числу атомов NA в 12 г углерода(2):
Зная количество вещества v и число NA, мы тем самым знаем число молекул N в веществе. Количество вещества выражают в молях.
Моль — это количество вещества, содержащего столько же молекул, сколько атомов содержится в углероде массой 12 г.
Если количество вещества равно, например, 2,5 моль, то это означает, что число молекул в теле в 2,5 раза превышает число атомов в 12 г углерода, т. е. равно 2,5A.
Постоянная Авогадро
Число молекул или атомов в моле вещества называют постоянной Авогадро. Это название дано в честь итальянского ученого XIX в. А. Авогадро(3).
Согласно определению моля постоянная Авогадро одинакова для всех веществ. Она равна, в частности, числу атомов в моле углерода, т. е. в 12 г углерода.
Существует много других методов определения постоянной Авогадро, не связанных с нахождением масс атомов. Все они приводят к одним и тем же результатам. Постоянная Авогадро играет важнейшую роль во всей молекулярной физике и является универсальной постоянной.
Огромная величина постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры.
Молярная масса
Наряду с относительной молекулярной массой Мr, в физике и химии широко используется понятие молярной массы М. Молярной массой называют массу вещества, взятого в количестве одного моля.
Согласно этому определению молярная масса равна произведению массы молекулы на постоянную Авогадро:
Молярная масса простым образом связана с относительной молекулярной массой. Подставив в формулу (2.2.4) выражения m0 из (2.2.2) и NA из (2.2.3), получим
Например, молярная масса воды Н2O равна 18 г/моль, или 0,18 кг/моль, так как относительная молекулярная масса воды приближенно равна 18.
Масса m произвольного количества вещества v и молярная масса М связаны соотношением
Так, масса 3 моль воды равна m = 3 моль • 0,018 кг/моль = 0,054 кг.
Используя формулы (2.2.6) и (2.2.2), можно получить формулу для числа молекул в теле в зависимости от массы тела m и молярной массы М
(1) Точнее, с 
(2) Если вещество состоит из отдельных атомов, не объединенных в молекулы, то здесь и в дальнейшем под числом молекул надо подразумевать число атомов.
(3) А. Авогадро (1776—1856) — итальянский физик и химик; автор четырехтомного труда, который был первым руководством по молекулярной физике.
Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса с примерами
Содержание:
Вода ее элементный состав, молекулярное строение, формула и молярная масса:
Вода — одно из важнейших химических соединений, широко распространенное на земном шаре.
Вода — это сложное вещество, состоящее из двух атомов водорода и одного атома кислорода (рис. 29).
Молекулярная формула воды —
Относительная молекулярная масса воды равна сумме относительных атомных масс водорода и кислорода:
Следовательно, масса 1 моля воды — 18 г, а молярная масса воды — 18 г/моль.
Вода и её физические свойства
Чистая вода — прозрачная жидкость без цвета, вкуса и запаха. Вкус и запах воде придают растворенные в ней примеси. Многие физические свойства воды очень своеобразны. При соответствующих обстоятельствах они являются аномальными, т.е. отклоняются от привычных. Например, плотность воды при переходе из твердого состояния (лед) в жидкое не уменьшается, как у большинства веществ, а увеличивается (рис. 30). Плотность растет и при нагревании воды от 0°С до + 4°С, достигая своего максимума — 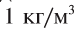
Еще одно свойство воды — это ее высокая теплоемкость (4,18 Дж/кг) (для сравнения: у песка —
0,79; известняка — 0,88; поваренной соли — 0,88; глицерина — 2,43; этилового спирта — 2,85). Поэтому вода в ночное время или при переходе от летнего сезона к зимнему медленно остывает, а в дневное время и при смене зимы летом так же медленно нагревается.
Вода замерзает при 0°С (при этой же температуре лед начинает таять) и превращается в пар (кипит) при 100°С.
Вода, являясь универсальным растворителем, растворяет многие органические и неорганические вещества.
Вода и её химические свойства
Молекулы воды очень устойчивы к нагреванию, но при температуре выше 1000°С пары воды начинают разлагаться на водород и кислород:
Реакционная способность воды очень велика.
Активные металлы, взаимодействуя с водой, выделяют из нее водород:
Рис. 30. Вода и лед
При взаимодействии с водой оксидов многих металлов и неметаллов образуются основания и кислоты:
Некоторые соли образуют с водой соединения, называемые кристаллогидратами:
Нагретое железо вступает в реакцию с парами воды:
Вода катализирует ряд химических процессов: при ее отсутствии «гремучий газ» не взрывается даже при высокой температуре, угарный газ не горит в кислороде, натрий и фосфор не окисляются на воздухе, не взаимодействуют с хлором и не происходит травления стекла фтористым водородом.
Распространение воды в природе
Три четверти поверхности земного шара покрыто водой в виде океанов, морей, озер, рек. Вода распространена в атмосфере в виде паров, на горных вершинах и полюсах — в виде ледников и снега. Существуют также подземные воды, увлажняющие почву и горные породы.
Объем Мирового океана составляет 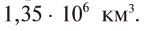
Вода имеет огромное значение в жизни растений, животных и людей. По современным представлениям, происхождение и развитие жизни на Земле было связано с морем. Вода — это среда, которая обеспечивает жизнедеятельность каждого организма посредством химических процессов, в ней протекающих. Кроме того, вода сама участвует в ряде биохимических процессов.
Аномальные физические свойства воды имеют важное значение в обеспечении жизненных процессов. Если бы плотность воды при переходе из жидкого состояния в твердое изменялась так же, как и у других веществ, то с приходом зимы поверхность воды, замерзая при 0°С, оседала бы ниже и уступала бы свое место более теплому слою, который также замерзал бы и оседал на дно. Таким образом вся вода превратилась бы в лед и многие формы жизни прекратили бы свое существование.
Но то, что вода при +4°С обладает максимальной плотностью, не дает происходить подобному явлению, так как обладающий меньшей плотностью лед остается на поверхности воды и предохраняет от замерзания более глубокие теплые слои.
Высокая теплоемкость воды также имеет большое значение для жизни на Земле. На нагревание воды необходимо затратить больше энергии, чем на нагревание любого другого вещества, т.е. вода, поглотившая тепло, нагревается при более низкой температуре, чем любая другая жидкость. Одна третья часть поглощаемой энергии Солнца расходуется на испарение воды Мирового океана и других водных бассейнов.
Вода выполняет специфическую роль терморегулятора и тем самым обеспечивает нормальную жизнедеятельность на поверхности Земли. Водные ресурсы земного шара могут быть как солеными, так и пресными, но все они имеют важное значение для промышленности.
Промышленность приспособлена для потребления в основном пресной воды. По имеющимся сведениям, в год на одного жителя планеты приходится в среднем 8000 л воды. Это количество воды используется как в бытовых, так в сельскохозяйственных и промышленных целях.
Только 10% расходуемой воды приходится на бытовые расходы, а остальное количество затрачивается на промышленность и сельское хозяйство. Для получения 1 кг сахара необходимо 400 л воды, для обработки 1 кг зерна — 1500 л, а для получения 1 кг синтетической резины необходимо примерно 2500 л воды.
В промышленности вода в основном используется как растворитель, охладитель и очиститель.
Пресная вода широко используется в сельском хозяйстве для полива полей и питья в животноводстве.
Повсеместное использование воды в промышленности связано с проблемами возникновения сточных вод и загрязнения окружающей среды. Для решения этих проблем необходим комплексный подход.
Не забывайте, что вода является бесценным богатством!
Меры по сохранению водных ресурсов от загрязнения
Для жизнедеятельности (т.е. для бытовых нужд, сельского хозяйства и промышленности) используют воды озер, рек, подземные воды и воды искусственных водоемов. Для водообеспечения большое значение имеет сохранение чистоты воды, которая загрязняется, проходя через систему канализационных сетей, промышленных предприятий, подвергаясь «обработке» путем смыва химических средств с полей.
Возвращаемые в водоемы сточные воды должны проходить соответствующую очистку, поскольку они могут быть загрязнены выбросами ферм, мусоросборников, городской канализацией, дренажными водами, остатками минеральных удобрений, инсектицидами, гербицидами, отходами больниц, торговых предприятий, общественного питания, заводов, фабрик и лабораторий. Такие воды должны быть подвергнуты многоступенчатой очистке. Сначала вода пропускается через механические фильтры, на которых задерживаются песок и другие частицы. Мелкие же частицы и многие бактерии осаждаются путем добавления в воду сначала извести, а затем сульфата алюминия. При пропускании воздуха через такую воду в ней усиливается разложение органических веществ. На последней стадии, чтобы очистить воду от бактерий, ее обрабатывают озоном или хлором. После такой стерилизации воду можно использовать для потребления.
При применении данного метода очистки вода очищается от вредных веществ. Но в некоторых случаях появляется необходимость ее очистки от ионов кальция и магния, повышающих жесткость воды. Эти ионы в сочетании с мылом образуют в воде нерастворимые соединения, отрицательно влияющие на эффективность синтетических моющих веществ. Такая вода при кипячении дает накипь. Многие подземные воды подвергаются такой очистке, потому что в результате взаимодействия известняка, а также других соединений магния и кальция содержание их ионов в воде возрастает. Эта вода обрабатывается гашеной или негашеной известью, а также содой. Потом проводят ее обработку квасцами. Такая вода полностью готова к употреблению.
Для очистки сточных вод существует особый способ, состоящий из трех стадий. На первой стадии очистку проходят 30% воды, на второй 60%, 10% воды не подвергаются очистке. При этом на первой стадии фильтрованием отделяются крупные твердые частицы, 60% которых могут выпасть в осадок. Если не подвергать такую воду вторичной очистке, то следует провести ее обеззараживание хлором и отправить в водоем.
При вторичной очистке посредством воздуха разлагаются органические вещества, увеличивается количество аэробных бактерий, которые, питаясь остатками органических веществ, очищают воду. Затем они осаждаются, а вода подвергается обработке хлором и сливается в водоем. На этой стадии можно осадить до 90% твердых частиц.
Вода, прошедшая первичную и вторичную обработку, может содержать значительное количество соединений фосфора и азота, что приводит к размножению водорослей в водоемах. Помимо этого, многие химические вещества, содержащиеся в сточных водах, пройдя эти стадии очистки, могут снова загрязнять окружающую среду и водные бассейны.
Однако полная очистка воды от многих металлов и органических веществ — очень дорогостоящая процедура. Поэтому вода в незначительных количествах подвергается третичной обработке, при которой с помощью специальных средств такие примеси ликвидируются.
Вода имеет огромное значение в жизни и практической деятельности человека. Процесс усвоения пищи связан с переводом питательных веществ в растворимые формы посредством воды. Все физиологически важные жидкости (кровь, лимфа и др.) — водные растворы. В основе многих сфер производственной деятельности лежат процессы, в которых используются водные растворы.
Жидкие растворы — это жидкие гомогенные (однородные) системы, состоящие из двух или более компонентов.
Общая поверхность Земли составляет 510100000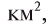
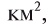
В природе вода широко распространена в виде растворенных в ней солей. Такие реки, как Ганг или Миссисипи, растворяют до 100 млн т солей в год, а все реки мира — 2,735 млрд т солей.
Почти все вещества растворяются в воде (рис. 31): некоторые — очень хорошо, другие — средне, а остальные — плохо.
Проходя через нижние слои атмосферы, дождевая вода может растворить значительное количество различных веществ. При выпаривании 1000 г дождевой воды остается 3—5 г твердого осадка.
Растворенные и попавшие в почву вещества, химически взаимодействуя с компонентами почвы и горных пород, активно участвуют в непрерывном процессе образования почвы и минералов, разрушения горных пород.
Рис. 31. Растворение различных веществ в воде:
1 — хлорид кальция; 2 — перманганат калия; 3 — пищевая соль; 4 — бихромат калия;5 — карбонат натрия; 6 — бертолетова соль
Рис. 32. Растворение сахара в воде
Вода — универсальный растворитель, который может растворять и газы (кислород, водород, углекислый газ и др.), и жидкости (спирт, кислоты и др.), и твердые вещества (соли, минералы и др.).
В воде растворяются в небольшом количестве даже те вещества, которые, казалось бы, совсем не растворяются в ней. К.В. Шееле, кипятя в течение 12 дней в колбе дистиллированную снеговую воду, отметил небольшое разъедание стенок колбы. А. Лавуазье, кипятя определенное количество воды в колбе в течение 101 дня, заметил, что масса сосуда уменьшилась на определенное число, а масса осадка, полученного после выпаривания воды, равняется этому числу. Следовательно, даже стекло незначительно растворяется в воде.
Способность вещества растворяться называется растворимостью.
Например, понаблюдаем растворение сахара в воде (рис. 32). При комнатной температуре (20°С) в 100 г воды может раствориться 200 г сахара. Большее количество сахара при этой температуре не растворится. Такой раствор называется насыщенным.
Мера растворимости определяется количеством вещества в насыщенном растворе при определенных условиях.
Растворимость определяется растворением вещества в 100 г растворителя. Если в растворителе растворяется больше 10 г вещества, то оно считается хорошо растворимым, если меньше 1 г — малорастворимым, если меньше 0,01 г — практически нерастворимым.
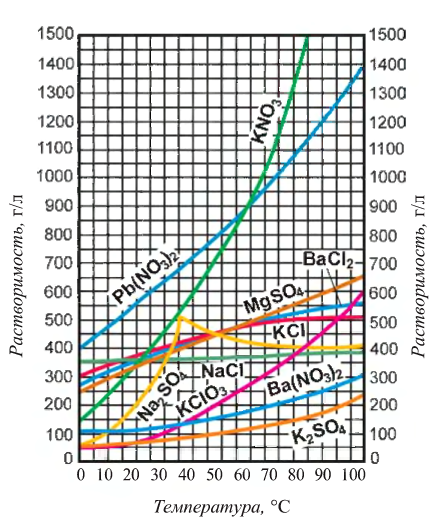
Растворимость многих твердых веществ возрастает с повышением температуры. Эту зависимость можно представить в виде графика (рис. 33).
Растворимость газов при повышении температуры уменьшается (при кипячении воды растворенные в ней газы выделяются).
Рис. 33. Кривые растворимости различных солей
Но повышение давления приводит к возрастанию их растворимости (открывая бутылку минеральной воды, мы уменьшаем давление внутри сосуда, и поэтому растворенный в ней углекислый газ начинает интенсивно выделяться).
Понятие о растворах и их концентрациях
Раствор — это однородная система, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Вещество в растворе измельчено до молекул, атомов или других частиц и равномерно распределено между молекулами растворителя, так как размеры частиц растворенного вещества составляют 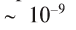
Растворы бывают жидкими, твердыми и газообразными. Примерами жидких растворов могут быть водные растворы соли, сахара, спирта; твердых растворов — золотометаллические изделия, сплавы типа дюралюминия; газообразных растворов — воздух или другие смеси газов.
При образовании растворов наблюдается выделение или поглощение тепла. Растворы могут хорошо проводить или не проводить электрический ток.
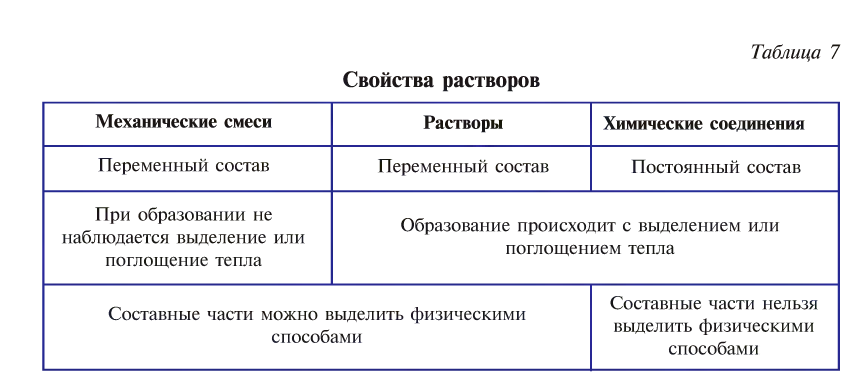
Растворы обладают свойствами как механических смесей, так и химических соединений (табл. 7).
При практическом применении растворов важное значение имеет точное определение количества вещества, растворенного в общей массе раствора.
Состав раствора (в частности, количество растворенного вещества) можно установить различными способами и выразить в размерных величинах (концентрациях).
Когда речь идет о компонентах раствора, под ними подразумеваются чистые вещества, при смешивании которых образуется раствор. При этом большее количество вещества принимается за растворитель, а меньшее — за растворенное вещество (рис. 34).
Эти термины были приняты для удобства, потому что при смешивании двух компонентов их нельзя строго разделять. При образовании раствора из чистой жидкости и твердого вещества обычно за растворитель принимается жидкий компонент. Независимо от того, что является растворенным веществом — газ, жидкость или твердое тело, — когда мы говорим о составе раствора, то обязаны учитывать отношение растворенного вещества к раствору. Это относительное количество называется концентрацией и выражается в различных величинах.
Обычно в химии концентрация выражается:
Рис.34 Соли (а)и их растворы (б)
Массовая доля, процентная, молярная и нормальная концентрация вещества в растворе
Как уже было сказано при изучении предыдущей темы, при определении состава раствора необходимо учитывать природу и количество его компонентов.
Насыщенный раствор — это раствор, который при данной температуре не может растворить большего количества вещества.
Ненасыщенный раствор — это раствор, который при данной температуре продолжает растворять вещество.
Если количество растворенного вещества очень мало, то такой раствор называется разбавленным.
Если количество растворенного вещества будет достаточно высоким, то такой раствор называется концентрированным (рис. 35).
В химии в основном пользуются ненасыщенными растворами.
Рис. 35. Взаимодействие цинка с растворами серной кислоты различной концентрации
В химической практике для выражения количества растворенного вещества широко применяются следующие величины:
1. Массовая доля 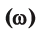
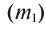
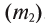
2. Процентная концентрация (С%) — выражение в процентах отношения массы растворенного вещества 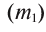
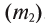
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.