Молярная масса хлора как округлить
Молярная масса хлора
Молярная масса хлора
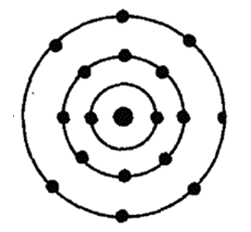
Порядковый номер – 17. Строение атома показано на рис. 1. Неметалл p-семейства.
Рис. 1. Схема строения атома хлора.
В обычных условиях хлор представляет собой газ желто-зеленого цвета, который хорошо растворяется в воде. При охлаждении из водных растворов выделяются кристаллогидраты, являющиеся кларатами приблизительного состава Cl2×6H2Oи Cl2×8H2O.
Относительная атомная масса атомарного хлора равна 35,453 а.е.м. Его относительная молекулярная масса будет равна 35,453, а молярная масса:
M(N) = Mr (N) × 1 моль = 35,453г/моль.
Известно, что молекула хлора двухатомна – Cl2, тогда, относительная атомная масса молекулы хлора будет равна:
Относительная молекулярная масса молекулы хлора будет равна 70,906, а молярная масса:
M(N2) = Mr (Cl2) × 1 моль = 70,906 г/моль или просто 71 г/моль.
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 л водорода? Газы находятся при одинаковых условиях. |
| Решение | Запишем уравнение реакции взаимодействия хлора с водородом: |
Рассчитаем количество вещества водорода, вступившего в реакцию:
n (H2)= 10 / 22,4 = 0,45 моль.
Согласно уравнению, n (H2)= n (Cl2)= 0,45 моль. Тогда, объем хлора, вступившего в реакцию взаимодействия с водородом равен:
Молярная масса хлора
Молярная масса хлора.
Молярная масса хлора:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅10 23 моль −1 ).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12 C.
Молярную массу обозначают M.
Молекула хлора двухатомна – Cl2.
Молярная масса хлора (M (Cl)) составляет 35,446-35,457 г/моль.
Молярная масса молекулы хлора (M (Cl2)) составляет 70,892-70,914 г/моль.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же. Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Хлор и его характеристики
Общая характеристика хлора
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl. Он встречается также и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли. В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита KCl×MgCl2×6H2O и сильвина KCl.
В обычных условиях хлор представляет собой газ желто-зеленого цвета (рис. 1), который хорошо растворяется в воде. При охлаждении из водных растворов выделяются кристаллогидраты, являющиеся кларатами приблизительного состава Cl2×6H2Oи Cl2×8H2O.
Рис. 1. Хлор в жидком состоянии. Внешний вид.
Атомная и молекулярная масса хлора
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного хлора равна 35,457 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула хлора двухатомна – Cl2. Относительная молекулярная масса молекулы хлора будет равна:
Изотопы хлора
Известно, что в природе хлор может находиться в виде двух стабильных изотопов 35 Cl (75,78%) и 37 Cl (24,22%). Их массовые числа равны 35 и 37 соответственно. Ядро атома изотопа хлора 35 Cl содержит семнадцать протонов и восемнадцать нейтронов, а изотоп 37 Cl– такое же количество протонов и двадцать нейтронов.
Существуют искусственные изотопы хлора с массовыми числами от 35-ти до 43-х, среди которых наиболее стабильным является 36 Cl с периодом полураспада равным 301 тысяча лет.
Ионы хлора
На внешнем энергетическом уровне атома хлора имеется семь электронов, которые являются валентными:
В результате химического взаимодействия хлор может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
Молекула и атом хлора
Молекула хлора состоит из двух атомов – Cl2. Приведем некоторые свойства, характеризующие атом и молекулу хлора:
Энергия ионизации атома, эВ
Сродство атома к электрону, эВ
Стандартная энтальпия диссоциации молекул при 25 o С, кДж/моль
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 л водорода? Газы находятся при одинаковых условиях. |
| Решение | Запишем уравнение реакции взаимодействия хлора с водородом: |
Рассчитаем количество вещества водорода, вступившего в реакцию:
n (H2)= 10 / 22,4 = 0,45 моль.
Согласно уравнению, n (H2)= n (Cl2)= 0,45 моль. Тогда, объем хлора, вступившего в реакцию взаимодействия с водородом равен:
Молярная масса хлора как округлить
Хлор ( χλωρός — зелёный) — элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природе
Изотопный состав
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %.
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35 Cl | 34.968852721 | Стабилен | — | 3/2 |
| 36 Cl | 35.9683069 | 301000 лет | β-распад в 36 Ar | 0 |
| 37 Cl | 36.96590262 | Стабилен | — | 3/2 |
| 38 Cl | 37.9680106 | 37,2 минуты | β-распад в 38 Ar | 2 |
| 39 Cl | 38.968009 | 55,6 минуты | β-распад в 39 Ar | 3/2 |
| 40 Cl | 39.97042 | 1,38 минуты | β-распад в 40 Ar | 2 |
| 41 Cl | 40.9707 | 34 c | β-распад в 41 Ar | |
| 42 Cl | 41.9732 | 46,8 c | β-распад в 42 Ar | |
| 43 Cl | 42.9742 | 3,3 c | β-распад в 43 Ar |
Физические и физико-химические свойства
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
Некоторые физические свойства хлора
| Свойство | Значение |
|---|---|
| Температура кипения | −34 °C |
| Температура плавления | −101 °C |
| Температура разложения (диссоциации на атомы) | |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
При охлаждении хлор превращается в жидкость при температуре около 239 К, а затем ниже 113 К кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
Растворимость
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
В реестре CAS — номер 7782-50-5.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 10 22 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойства
Строение электронной оболочки
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
|---|---|---|---|
| I | +1, −1 | 3s 2 3p 5 | NaCl, NaClO |
| III | +3 | 3s 2 3p 4 3d 1 | NaClO2 |
| V | +5 | 3s 2 3p 3 3d 2 | NaClO3 |
| VII | +7 | 3s 1 3p 3 3d 3 | NaClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
Взаимодействие с неметаллами
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
Другие свойства
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
Действие хлора на аммиак можно получить трёххлористый азот:
Окислительные свойства хлора
Хлор очень сильный окислитель.
Реакции с органическими веществами
Присоединяется к ненасыщенным соединениям по кратным связям:
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
Хлор способы получения хлора
Промышленные методы
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Диафрагменный метод с твердым катодом
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизера непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод с твердым катодом
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Ртутный метод с жидким катодом
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизера служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизер непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
Лабораторные методы
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
Хранение хлора
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль хлора
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхнисти от солнечного света. В России галофиты произрастают на соляных куполах, выходах соляных отложений и засоленных понижениях вокруг соляных озёр Баскунчак, Эльтон.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Молярная масса хлора как округлить
Хлор / Chlorum (Cl), 17
3,214 г/л;
(жид. при −35 °C) 1,557;
(тв. при −105 °C) 1,9 г/см³
172,2 K ( Ошибка выражения: неопознанный символ пунктуации « »°C)
238,6 K ( Ошибка выражения: неопознанный символ пунктуации « »°C)
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Содержание
История открытия хлора
Соединение с водородом — газообразный хлороводород — было впервые получено Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную муриевую (соляную) кислоту. Бертолле и Лавуазье в рамках кислородной теории кислот обосновали, что новое вещество должно быть оксидом гипотетического элемента мурия. Однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор, доказав элементарную природу последнего.
Распространение в природе
В природе встречаются два изотопа хлора 35 Cl и 37 Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6Н2О, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л [4] ). На долю хлора приходится 0,025 % от общего числа атомов земной коры; кларковое число хлора — 0,017 %. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.










































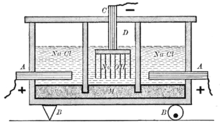

 — основной процесс
— основной процесс 
 Катод:
Катод:  — основной процесс
— основной процесс 






