Металлическая связь как образуется примеры
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
Эти свойства связаны с существованием в металлах металлической связи:
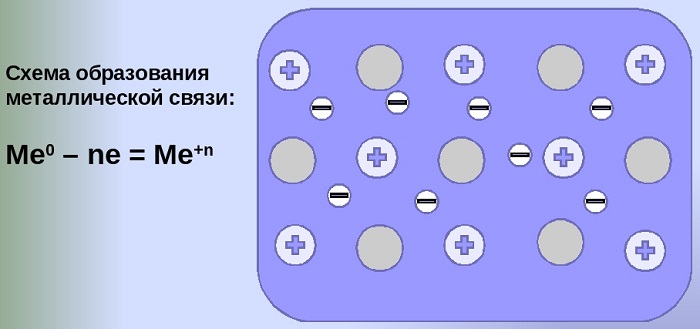
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
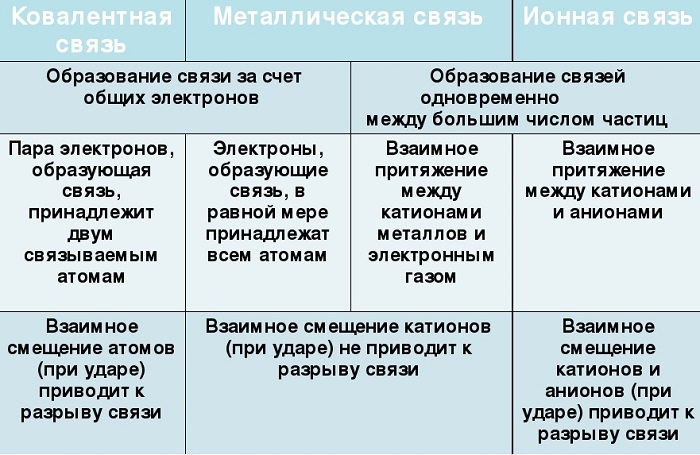
Отличие металлической связи от ковалентной
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.
Металлическая химическая связь

Всего получено оценок: 436.
Всего получено оценок: 436.
Металлическая связь образуется между атомами в кристалле металла, возникающая за счет перекрытия валентных электронов. Так, что же представляет собой этот вид связи, и в каких соединениях она присутствует?
Что такое металлическая связь?
Металлическая химическая связь существует в металлическом кристалле и в жидком расплавленном состоянии. Ее образуют элементы, атомы которых на внешнем уровне имеют мало электронов (1-3) по сравнению с общим числом внешних, энергетически близких орбиталей.

Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Так, у атома натрия на один валентный электрон (3S1) приходится 9 свободных и энергетически близких орбиталей (одна 3s, три 3p и пять 3d).
Химическая связь сильно делокализована: электроны обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального, между положительно заряженными ионами.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро- и теплопроводность.
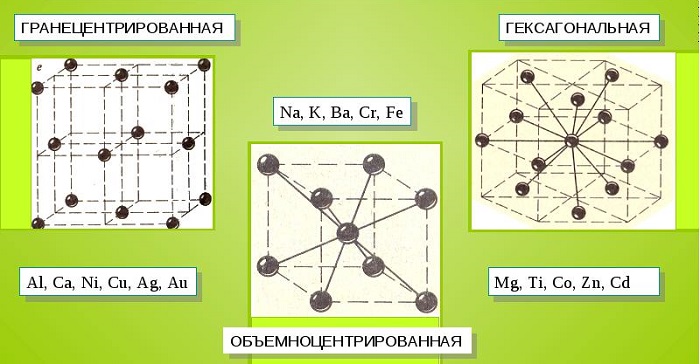
Характерные кристаллические решетки
Металлы почти всегда образуют высокосимметричные решетки с плотно приближенными друг к другу атомами. Выделяют три вида кристаллических решеток:
Такой тип кристаллической решетки имеют следующие металлы: магний, кадмий, рений, осмий, рутений, бериллий и многие другие.
Что мы узнали?
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами. В данной статье дается определение понятию «металлическая связь», а также приведены примеры металлической химической связи.
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
Новости
Металлическая связь
Металлы обладают небольшим количеством валентных электронов, которые легко отрываются от собственных ядер, так как довольно слабо связаны с ними. В связи с этим электроны заполняют всё пространство взаимодействующих орбиталей, а значит их перемещение в кристаллической решётке происходит беспрепятственно. 
Механизм образования металлической связи
Основополагающим условием при образовании этого типа связи является наличие свободных атомных орбиталей и электронов, которые в связи с малыми значениями энергии ионизации способны легко отрываться от ядра. Таким образом металлическая связь может образовываться как между атомами, так и между ионами в узлах кристаллической решётки.
Механизм образования металлической связи можно изобразить схемой:
Кристаллические решётки веществ с металлической связью
Характеристики металлической связи
Еще по этой теме:
Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.
Теперь «ХиШник» стал полностью бесплатным
Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.
Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.
Таблицы для ЕГЭ по химии
В статье представлены таблицы, необходимые при изучении химии и сдаче ЕГЭ.
Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.
Формулы для решения задач по химии
Перечень основных формул, которые используются при решении школьных задач по химии.
Химические профессии
Обзор необычных профессий, связанных с химией.
ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.
Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.
Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.
Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.
Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.
Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Ионная связь
Статья, содержащая в себе базовые понятие об ионном виде химической связи.
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
В статье дано несколько действенных советов по подготовке к ЕГЭ по химии «с нуля».
Ковалентная связь
Начинаем серию статей про виды химической связи.
Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)
«ХиШник» приехал на Сахалин!
Этим летом открывается очередная летняя сессия областной профильной школы для одаренных детей «Эврика».
Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Что такое право само по себе и откуда оно берется. Как не заработать славу скандалистов, «вечно качающих права», и при этом не переносить безропотно нарушение своих личных границ…
Современный задачник по химии
материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Научиться решать задачи по химии легко: следуем инструкции
Учимся решать задачи по химии к ОГЭ, ЕГЭ, инструкция от ХиШника
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.
Обновление в демонстрационной версии «ХиШника»
Мы расширили приветственное окно, чтобы при входе в приложение всем новым пользователям были понятны основные принципы работы «ХиШника».
Активация лицензионного ключа и первые шаги в «ХиШнике».
Что такое лицензионный ключ и как происходит его активация в приложении
Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?
ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Родина приложения «ХиШник» – Новосибирский Академгородок
Почему же родиной «ХиШника» стал Новосибирский Академгородок?
Совпадение не случайное.
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
Итак, «ХиШник» это приложение, в котором могут работать и ученики, и преподаватели. После того, как преподаватель создает в приложении учебную группу
Можно ли заниматься в «ХиШнике» со смартфона/планшета?
Сегодня у нас вопрос, которого мы давно ждали: можно ли заниматься в «ХиШнике» со смартфона/планшета?
Семинар от «ХиШника» на КПК для учителей химии
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
Вчера команда «ХиШника» провела мастер-класс для преподавателей химии и методистов программ повышения квалификации из разных регионов России.
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!
«ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
Ярмарка кейсов «Школы реальных дел» – уже в эту пятницу! В этом году «ХиШник» представляет два кейса.
Служба поддержки:
support@hishnik-school.ru
Для СМИ:
onp@alekta.ru
Спасибо!
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
Металлическая химическая связь — характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность — большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.