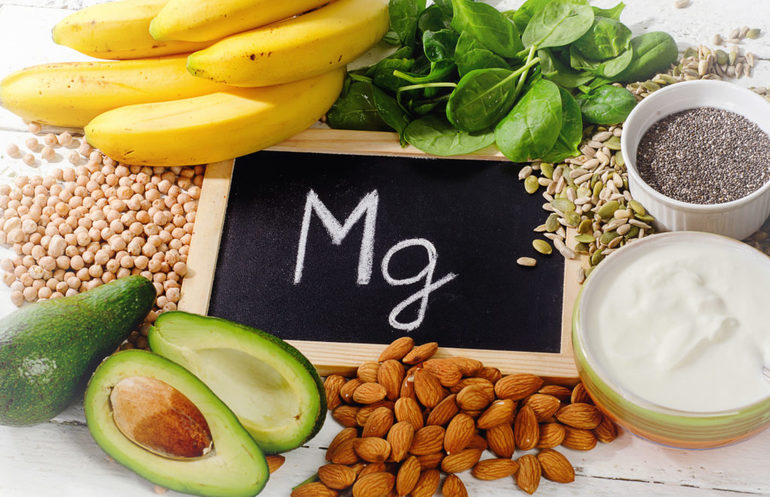Магний как химический элемент характеристика
Магний (Mg, Magnesium)
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
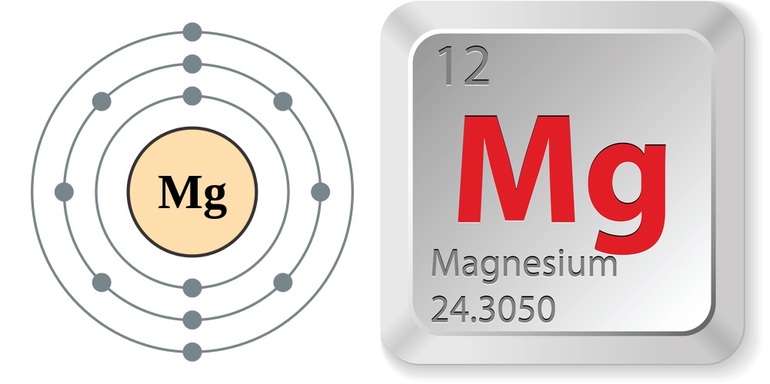
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
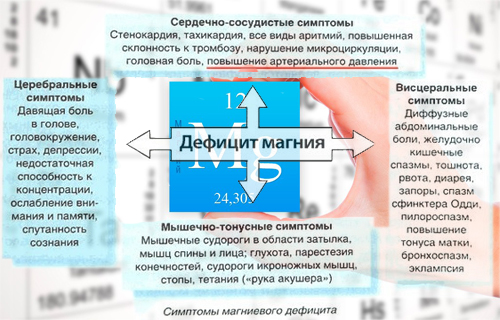
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Магний, свойства атома, химические и физические свойства
Магний, свойства атома, химические и физические свойства.
24,304-24,307 1s 2 2s 2 2p 6 3s 2
Магний — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 12. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Физические свойства магния
Атом и молекула магния. Формула магния. Строение магния:
Магний (лат. Magnesium, от др.-греч. βαρύς – «тяжёлый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Mg и атомным номером 12. Расположен в 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Магний – щёлочноземельный металл. Относится к группе цветных металлов.
Магний обозначается символом Mg.
Как простое вещество магний при нормальных условиях представляет собой лёгкий, ковкий металл серебристо-белого цвета.
Молекула магния одноатомна.
Химическая формула магния Mg.
Строение атома магния. Атом магния состоит из положительно заряженного ядра (+12), вокруг которого по трем атомным оболочкам движутся 12 электронов. При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона. В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов. Магний относится к элементам s-семейства.
Радиус атома магния (вычисленный) составляет 145 пм.
Атомная масса атома магния составляет 24,304-24,307 а. е. м.
Изотопы и модификации магния:
Свойства магния (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Магний |
| 102 | Прежнее название | |
| 103 | Латинское название | Magnesium |
| 104 | Английское название | Magnesium |
| 105 | Символ | Mg |
| 106 | Атомный номер (номер в таблице) | 12 |
| 107 | Тип | Металл |
| 108 | Группа | Цветной, щёлочноземельный металл |
| 109 | Открыт | Джозеф Блэк, Шотландия, 1755 г., Хемфри Дэви, Великобритания, 1808 г., Антуан Александр Брутус Бюсси, Франция, 1829 г. |
| 110 | Год открытия | 1755 г. |
| 111 | Внешний вид и пр. | Лёгкий, ковкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,9 % |
| 120 | Содержание в морях и океанах (по массе) | 0,13 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,06 % |
| 122 | Содержание в Солнце (по массе) | 0,07 % |
| 123 | Содержание в метеоритах (по массе) | 12 % |
| 124 | Содержание в организме человека (по массе) | 0,027 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 24,304-24,307 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 |
| 203 | Электронная оболочка | K2 L8 M2 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 150 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Mg 2+ 1,584 г/см 3 (при температуре плавления 650 °C и иных стандартных условиях , состояние вещества – жидкость), 1,57 г/см 3 (при 651 °C и иных стандартных условиях , состояние вещества –жидкость) |
| 402 | Температура плавления | 650 °C (923 K, 1202 °F) |
| 403 | Температура кипения | 1090 °C (1363 K, 1994 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 8,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 128 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,983 Дж/г·K (при 25 °C), 1,6 Дж/г·K (при 100 °C), 1,31 Дж/г·K (при 650 °C) |
| 410 | Молярная теплоёмкость* | 24,869 Дж/(K·моль) |
| 411 | Молярный объём | 13,984 см³/моль |
| 412 | Теплопроводность | 156 Вт/(м·К) (при стандартных условиях ), 156 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-95-4 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома магния согласно [1] составляет 160 пм.
206* Ковалентный радиус магния согласно [1] и [3] составляет 141±7 пм и 136 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) магния согласно [3] составляет 9,20 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) магния согласно [3] составляет 131,8 кДж/моль.
410* Молярная теплоемкость магния согласно [3] составляет 24,90 Дж/(K·моль).
Физические свойства магния:
Химические свойства магния. Взаимодействие магния. Реакции с магнием:
1. Реакция взаимодействия магния и водорода:
В результате реакции образуются гидрид магния. Реакция протекает при избыточном давлении.
2. Реакция окисления кислородом магния:
2Mg + O2 → 2MgO (t = 600-650 °C).
3. Реакция взаимодействия магния и хлора:
В результате реакции образуются хлорид магния.
4. Реакция взаимодействия магния и кремния:
В результате реакции образуются силицид магния. Реакция протекает при сплавлении реакционной смеси.
5. Реакция взаимодействия магния и азота:
В результате реакции образуются нитрид магния.
6. Реакция взаимодействия магния и фосфора:
В результате реакции образуются фосфид магния.
7. Реакция взаимодействия бора и магния:
В результате реакции образуются борид магния.
8. Реакция взаимодействия висмута и магния:
В результате реакции образуются висмутид магния.
9. Реакция взаимодействия сурьмы и магния:
В результате реакции образуются стибид магния.
10. Реакция взаимодействия магния и воды:
В результате реакции образуются гидроксид магния и водород. В ходе реакции используется горячая вода.
11. Реакция взаимодействия оксида бериллия и магния:
BeO + Mg → MgO + Be (t = 700-800 °C).
В результате реакции образуются оксид магния и бериллий.
12. Реакция взаимодействия оксида азота (I) и магния:
В результате реакции образуются азот и оксид магния.
13. Реакция взаимодействия оксида азота (II) и магния:
2NO + 2Mg → N2 + 2MgO (t ≈ 500 °C).
В результате реакции образуются азот и оксид магния.
14. Реакция взаимодействия магния и тетраоксида диазота:
В результате реакции образуются нитрат магния и оксид азота.
15. Реакция взаимодействия оксида лития и магния:
Li2O + Mg → 2Li + MgO (t = 800 °C).
В результате реакции образуются литий и оксид магния.
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 °C).
В результате реакции образуются гидрид лития и оксид магния.
17. Реакция взаимодействия оксида бора и магния:
В результате реакции образуются в первом случае – борид магния и оксид магния, во втором – бор и оксид магния.
Вторая реакция представляет собой метод получения аморфного бора. Полученный бор – бор Муассана, чистота 95-98 %.
18. Реакция взаимодействия оксида углерода и магния:
CO2 + 2Mg → 2MgO + C (t ≈ 500 °C).
В результате реакции образуются оксид магния и углерод. В ходе реакции происходит сжигание магния в среде углекислого газа.
19. Реакция взаимодействия оксида кремния и магния:
SiO2 + 2Mg → Si + 2MgO (t ≈ 1000 °C),
SiO2 + 4Mg → Mg2Si + 2MgO (t = 800 °C).
В результате реакции образуются в первом случае – кремний и оксид магния. Первая реакция представляет собой лабораторный метод получения кремния осуществляют следующем образом: смесь сухого песка и измельченного магния зажигают магниевой лентой.
Во втором случае в результате реакции образуются силицид магния и оксид магния. Реакция протекает при температуре не более 800°C в атмосфере водорода.
CaO + H2 + Mg → CaH2 + MgO (t = 800-900 °C).
В результате реакции образуются гидрид кальция и оксид магния.
21. Реакция взаимодействия магния и бромоводорода:
В результате реакции образуются бромид магния и водород. В ходе реакции используется разбавленный раствор бромоводорода.
22. Реакция взаимодействия магния и фтороводорода:
В результате реакции образуются фторид магния и водород. В ходе реакции используется разбавленный раствор фтороводорода.
23. Реакция взаимодействия магния и сероводорода:
В результате реакции образуются сульфид магния и водород.
24. Реакция взаимодействия магния и азотной кислоты:
В результате реакции образуются в первом случае – нитрат магния, азот и вода, во втором – нитрат магния, оксид азота (I) и вода, в третьем – нитрат магния, оксид азота (I), оксид азота (II) и вода. В ходе реакции в первом и втором случае применяется разбавленная азотная кислота, в третьем – 30%-й раствор азотной кислоты.
25. Реакция взаимодействия магния и ортофосфорной кислоты:
В результате реакции образуются ортофосфат магния и водород. При этом в ходе реакции используется разбавленный раствор ортофосфорной кислоты.
Аналогичные реакции проходят и с другими кислотами.
26. Реакция взаимодействия магния и аммиака:
В результате реакции образуются нитрид магния и водород.
27. Реакция взаимодействия фторида бериллия и магния:
BeF2 + Mg → MgF2 + Be (t = 700-750 °C).
В результате реакции образуются фторид магния и бериллий.
28. Реакция взаимодействия фторида кремния и магния:
SiF4 + 2Mg → Si + 2MgF2 (t = 500-600 °C).
В результате реакции образуются кремний и фторид магния. В ходе реакции применяется примесь – силицид магния Mg2Si.
29. Реакция взаимодействия карбоната лития и магния:
30. Реакция взаимодействия магния и карбоната рубидия:
31. Реакция взаимодействия карбида кремния и магния:
2SiC + 5Mg → 2Mg2Si + MgC2 (t ≈ 700°C).
В результате реакции образуются силицида магния и карбида магния.
32. Реакция взаимодействия хлорида олова и магния:
SnCl2 + Mg → MgCl2 + Sn (t = 200-300 °C).
В результате реакции образуются хлорид магния и олово.
33. Реакция взаимодействия хлорида ванадия и магния:
В результате реакции образуются ванадий и хлорид магния.
34. Реакция взаимодействия хлорида железа и магния:
2FeCl3 + 3Mg → 2Fe + 3MgCl2 (t = 300-400 °C).
В результате реакции образуются железо и хлорид магния.
35. Реакция взаимодействия хлорида титана и магния:
TiCl4 + 2Mg → Ti + 2MgCl2 (t = 800-850 °C).
В результате реакции образуются титан и хлорид магния. В ходе реакции используется магний в виде расплава. Реакцию проводят при температуре в отсутствие воздуха в атмосфере аргона.
36. Реакция взаимодействия хлорида гафния и магния:
HfCl4 + 2Mg → Hf + 2MgCl2 (t = 650-700 °C).
В результате реакции образуются гафний и хлорид магния.
37. Реакция взаимодействия хлорида циркония и магния:
ZrCl4 + 2Mg → Zr + 2MgCl2 (t ≈ 700 °C).
В результате реакции образуются цирконий и хлорид магния.
38. Реакция взаимодействия хлорида тантала и магния:
2TaCl5 + 5Mg → 2Ta + 5MgCl2 (t ≈ 750°C).
В результате реакции образуются тантал и хлорид магния.
39. Реакция взаимодействия хлорида ванадия, оксида углерода и магния:
В результате реакции образуются гексакарбонилванадат магния и хлорид магния. Реакция протекает в пиридине при температуре около 135°C и избыточном давлении.
40. Реакция взаимодействия сульфата бериллия, воды и магния:
В результате реакции образуются гидроксосульфат бериллия, сульфат магния и водород.
41. Реакция взаимодействия сульфида титана и магния:
TiS2 + 2Mg → 2MgS + Ti (t ≈ 1000 °C).
В результате реакции образуются сульфид магния и титан. Реакция протекает в атмосфере аргона.
42. Реакция взаимодействия тетрабората натрия и магния:
43. Реакция взаимодействия магния и пентана :
В результате реакции образуются карбид магния и водород. Реакция протекает при нагревании до температуры не более 700°C.
44. Реакция взаимодействия магния и циклопентадиена:
В результате реакции образуются циклопентадиенил магния и водород.
45. Реакция взаимодействия магния и ацетилена:
В результате реакции образуются карбид магния и водород.
История открытия
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Непосредственно магний впервые был получен Хэмфри Дэви в 1808 г. Учёный проводил электролиз белой магнезии, в которую он добавил небольшое количество воды и ртутной окиси. Эта реакция привела к образованию амальгамы металлического вещества. Полученный металл после выведения получил название «магний».
Следует отметить, что реактив имел различные примеси. Чистый элемент в 1829 г. вывел французский химик Антуан Александр Брутус Бюсси.
Определение и физическая характеристика
Вещество является представителем II группы периодической системы химических элементов.
Ему можно дать следующую характеристику:
Реагент в компактном состоянии представляет собой блестящий металл серебристо-белого цвета. Под воздействием воздуха он тускнеет, так как на поверхности образуется плёнка окиси.
Горит металлический реагент ослепительным пламенем белого цвета. Скорость, с которой вспыхивает вещество, во много раз превосходит скорость одёргивания руки. Из-за этого физического свойства магния человеку, поджигающему элемент, необходимо соблюдать все положенные правила техники безопасности. В противном случае, он получит серьёзный ожог кожи. Для наблюдения за процессом горения следует использовать тёмные очки или стекло. Без этих мер предосторожности повышает риск получения ожога сетчатки, который приводит к временной слепоте.
Химические свойства
Все стабильные соединения элемента имеют валентность равную двум, а электронная формула магния или схематичное строение его атома имеет вид: 1s2 2s2 2p6 3s2.
Даже при нагревании до 350 °C компактный магний подвергается незначительному окислению, поскольку он покрыт оксидной плёнкой. Горит реагент при температуре от 600 до 650 °C, при этом образуются оксид и нитрит элемента. Нитрит также можно получить, нагрев вещество до 500 °C в азотной среде.
Элемент относится к активным веществам. Кроме того, выделяют следующие химические свойства магния:
Реагент представляет собой сильный восстановитель. Нагретый магний вытесняет некоторые металлы и неметаллы из оксидов и галогенидов. Существует множество металлоорганических соединений вещества, которые делают его одним из важнейших элементов органического синтеза.
Реагент легко создаёт сплавы со многими металлами, а потому на нём основывается производство множества очень важных лёгких материалов.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются. Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан. Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Вещество в составе различных соединений накапливается в солях, остающихся после того, как из лагун испаряется вода.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния. В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C. Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение вещества
Наибольшее количество металла потребляет металлургия. На его основе создаётся множество сплавов. Часто вещество используют в металлотермических процессах, чтобы получить редкие металлы, а также те, которые трудно восстановить. Применяется реагент для раскисления и десульфурации металлических веществ. Различные порошковые смеси на основе магния используются в качестве осветительных и зажигательных.
Соединения, содержащие реагент, нашли широкое применение в различных сферах жизнедеятельности. К примеру, в медицине, лекарства с магнием позволяют избавить пациентов от спазмов и судорог, успокоить нервы и так далее.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Входит этот реагент и в состав хлорофилла зелёных растений. В общей сложности на их долю приходится 100 миллиардов тонн вещества. Учёные обнаружили магний во всех компонентах, необходимых клеткам живых организмов для существования. Этот элемент запускает многие ферменты и позволяет хромосомам и коллоидным системам растений сохранять стабильность. Кроме того, реагент поддерживает в клетках тургорное давление. Благодаря магнию растения лучше поглощают и усваивают находящийся в земле фосфор.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.
Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
Когда в почве содержится недостаточное количество вещества, у растений начинается мраморность листвы и хлороз. Отсутствие магния в рационе вызывает у крупного рогатого скота травяную тетанию.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.