ксенон номер в таблице
Ксенон Xe
Ксенон в таблице менделеева занимает 54 место, в 5 периоде.
| Символ | Xe |
| Номер | 54 |
| Атомный вес | 131.2930000 |
| Латинское название | Xenon |
| Русское название | Ксенон |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема ксенона
Xe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6
Порядок заполнения оболочек атома ксенона (Xe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Ксенон имеет 54 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
Степень окисления ксенона
Атомы ксенона в соединениях имеют степени окисления 8, 6, 4, 3, 2, 0.
Ионы ксенона
Валентность Xe
Атомы ксенона в соединениях проявляют валентность VIII, VI, IV, III, II.
Валентность ксенона характеризует способность атома Xe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Xe
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Ксенон, свойства атома, химические и физические свойства
Ксенон, свойства атома, химические и физические свойства.
131,293(6) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6
Ксенон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 54. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), пятом периоде периодической системы.
Атом и молекула ксенона. Формула ксенона. Строение атома ксенона:
Ксенон – неметалл. Относится к группе инертных (благородных) газов.
Ксенон обозначается символом Xe.
Как простое вещество ксенон при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула ксенона одноатомна.
Химическая формула ксенона Xe.
Строение атома ксенона. Атом ксенона состоит из положительно заряженного ядра (+54), вокруг которого по пяти оболочкам движется 54 электрона. При этом 46 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку ксенон расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома ксенона на 5s-орбитали находятся два спаренных электрона, на 5p-орбитали находятся шесть спаренных электрона. В свою очередь ядро атома ксенона состоит из 54 протонов и 77 нейтронов. Ксенон относится к элементам p-семейства.
Радиус атома ксенона (вычисленный) составляет 108 пм.
Атомная масса атома ксенона составляет 131,293(6) а. е. м.
Ксенон – химически инертный химический элемент.
Изотопы и модификации ксенона:
Свойства ксенона (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Ксенон |
| 102 | Прежнее название | |
| 103 | Латинское название | Xenon |
| 104 | Английское название | Xenon |
| 105 | Символ | Xe |
| 106 | Атомный номер (номер в таблице) | 54 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Траверс Моррис Уильям, Англия, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
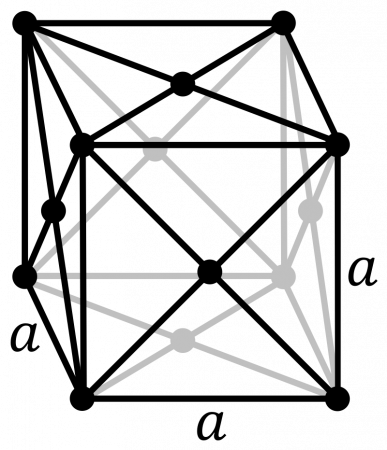
| 114 | Аллотропные модификации | 2 аллотропные модификации: – ксенон с кубической гранецентрированной кристаллической решёткой, |
| 204 | Радиус атома (вычисленный) | 108 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 140 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 216 пм |
| 209 | Электроны, Протоны, Нейтроны | 54 электрона, 54 протона, 77 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +4, +6, +8 |
| 302 | Валентность | 0, II, IV, VI, VIII |
| 303 | Электроотрицательность | 2,6 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1170,35 кДж/моль (12,1298436(15) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | 0 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,005894 г/см 3 (при 0 °C/20 °C и иных стандартных условиях , состояние вещества – газ), |
| 513 | Параметры решётки | 6,200 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-63-3 |
206* Ковалентный радиус ксенона согласно [1] составляет 140±9 пм.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) ксенона согласно [4] составляет 2,3 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) ксенона согласно [3] составляет 12,65 кДж/моль.
410* Молярная теплоемкость ксенона согласно [3] составляет 20,79 Дж/(K·моль).
Ксенон, свойства атома, химические и физические свойства
Ксенон, свойства атома, химические и физические свойства.
131,293(6) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6
Ксенон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 54. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), пятом периоде периодической системы.
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Ксенон |
| 102 | Прежнее название | |
| 103 | Латинское название | Xenon |
| 104 | Английское название | Xenon |
| 105 | Символ | Xe |
| 106 | Атомный номер (номер в таблице) | 54 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Траверс Моррис Уильям, Великобритания, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: |
— ксенон с кубической гранецентрированной кристаллической решёткой,
Ксенон
(молярная масса)
(первый электрон)
0,005894 (при 0 °C) г/см³
гранецентрированая
Ксенон — элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54. Обозначается символом Xe (лат. Xenon ). Простое вещество ксенон — благородный одноатомный газ без цвета, вкуса и запаха.
Содержание
История
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названия
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см 3 ксенона.
В Солнечной системе
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133 Xe и 135 Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии с длиной волны 467,13 нм и 462,43 нм ). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Свойства
Физические свойства
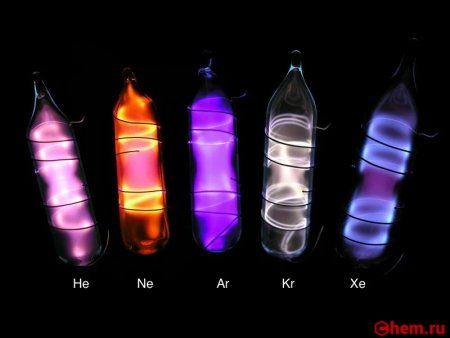
В электрическом разряде светится синим цветом (462 и 467 нм). Жидкий ксенон является сцинтиллятором.
Слабо растворим в воде (0,242 л/кг при 0 °C, 0,097 л/кг при 25 °C).
Химические свойства
Ксенон стал первым инертным газом, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Изотопы
Известны изотопы ксенона с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93), и 12 ядерных изомеров.
9 изотопов встречаются в природе. Из них стабильными являются семь: 126 Xe, 128 Xe, 129 Xe, 130 Xe, 131 Xe, 132 Xe, 134 Xe. Еще два изотопа ( 124 Xe и 136 Xe) имеют огромные периоды полураспада, много больше возраста Вселенной.
Остальные изотопы искусственные, самые долгоживущие — 127 Xe (период полураспада 36,345 суток) и 133 Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131 Xe m с периодом полураспада 11,84 суток, 129 Xe m (8,88 суток) и 133 Xe m (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и йода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1—0,2 % криптоно-ксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В дальнейшем ксеноно-криптоновый концентрат может быть разделён дистилляцией на криптон и ксенон, подробнее см. Криптон#Получение.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
Ксенон
Ксенон — элемент главной подгруппы восьмой группы, пятого периода периодической системы химических элементов, с атомным номером 54. Обозначается символом Xe (Xenon). Простое вещество ксенон (CAS-номер: 7440-63-3) — инертный одноатомный газ без цвета, вкуса и запаха. Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
Происхождение названия
Распространённость
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0.08 миллионной доли, хотя содержание 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. У Юпитера, напротив, необычно высокая концентрация ксенона в атмосфере — почти в два раза выше, чем у Солнца.
Земная кора
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные изотопы ксенона, например, 133 Xe и 135 Xe, получаются как результат нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии 467,13 нм и 462,43 нм). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Физические свойства
Температура плавления −112 °C,температура кипения −108 °C,свечение в разряде фиолетовым цветом.
Химические свойства
Изотопы ксенона
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0.1-0.2 % криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон. Из-за своей малой распространенности, ксенон гораздо дороже более легких инертных газов.
Применение
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
Биологическая роль
Ксенон не играет никакой биологической роли.
Физиологическое действие
Газ ксенон безвреден, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях (более 80 %) вызывает асфиксию.
Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м³.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда